点眼薬で感染症や死亡の報告、メーカーがリコール発表 米FDA
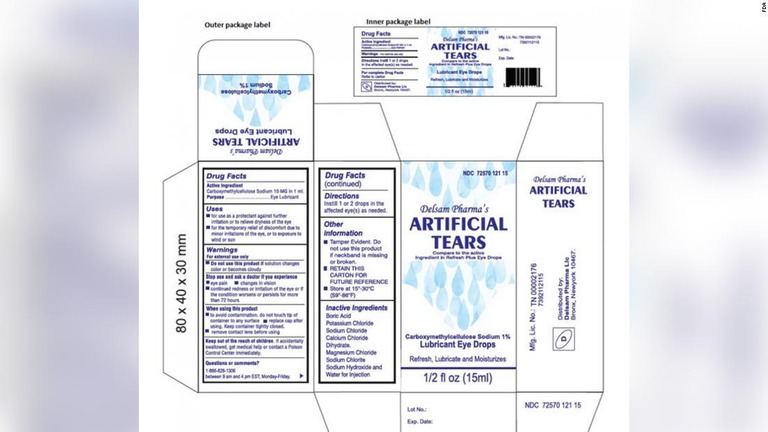
(CNN) 製薬会社のグローバル・ファーマ・ヘルスケアは、米国内で流通している人工涙点眼薬「Artificial Tears Lubricant Eye Drops」について、感染症を引き起こす可能性があるとしてリコールを発表した。米食品医薬品局(FDA)が2日に明らかにした。
問題の点眼薬は、米エズリケアとデルサム・ファーマの2社を通じて全米でネット販売されていた。FDAは消費者に使用中止を呼びかけるとともに、副作用があればFDAに報告するよう促している。
米疾病対策センター(CDC)は、12州で報告された55件の感染症の症例について、この製品に関係している可能性があるとみて調べている。
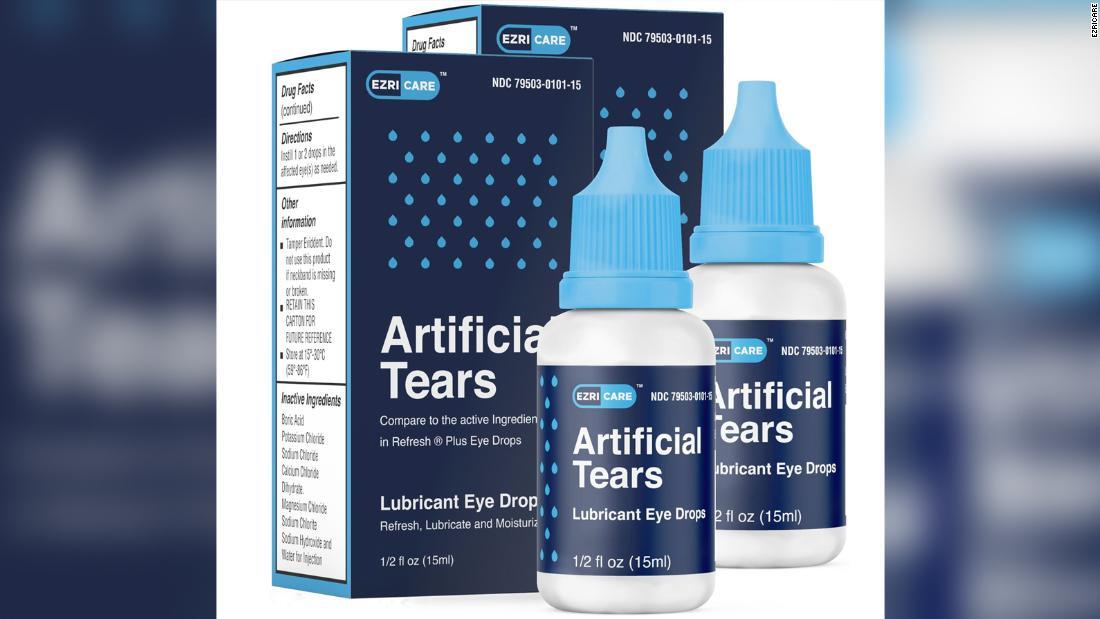
米エズリケアから販売された点眼薬/EzriCare
CDCによれば、角膜、眼内液、呼吸器、尿路の感染症や、敗血症の症例が報告されている。視力を失ったり入院したりした患者もいるほか、1人が死亡しているという。
感染症を報告した人のほとんどが、人工涙の点眼薬10種類あまりのうち少なくとも1種類を使用しており、大部分はエズリケアの製品を使っていた。こうした点眼薬は防腐剤不使用で、細菌の繁殖を防ぐ成分が入っていない。
CDCによると、開封済みのエズリケアの容器を検査した結果、幅広い抗生物質に対して耐性を持つ緑膿(りょくのう)菌が検出された。緑膿菌は使用中または製造過程で混入した可能性がある。未開封の容器についても検査が行われている。
エズリケアは声明を発表し、今回の調査については1月20日に把握し、直ちに流通や販売を停止させる措置を講じたと説明している。